Terapia cu anticorpi AstraZeneca, autorizată în SUA pentru cei care nu reacționează bine la vaccin
Autorităţile sanitare americane au autorizat miercuri administrarea de anticorpi de sinteză dezvoltaţi de AstraZeneca la anumite persoane care nu reacţionează bine la vaccinuri din motive medicale, pentru a le proteja împotriva COVID-19 înainte de orice expunere la virus.
Este pentru prima dată când Agenţia pentru Medicamente din SUA (FDA) a autorizat în regim de urgenţă un astfel de tratament cu rol de prevenţie. Însă, această terapie nu este „un înlocuitor al vaccinării”, a avertizat agenţia.
Tratamentul este autorizat doar pentru persoanele imunodeprimate (la care este probabil ca vaccinul să funcţioneze mai puţin bine) sau pentru cei care nu pot fi vaccinaţi din motive medicale (de exemplu, au reacţii alergice puternice).
În aceste cazuri, tratamentul se poate administra persoanelor începând cu vârsta de 12 ani.
Citește și: EXCLUSIV Șeful de cabinet al lui Grindeanu, plătit de o firmă chineză de pe lista neagră a SUA
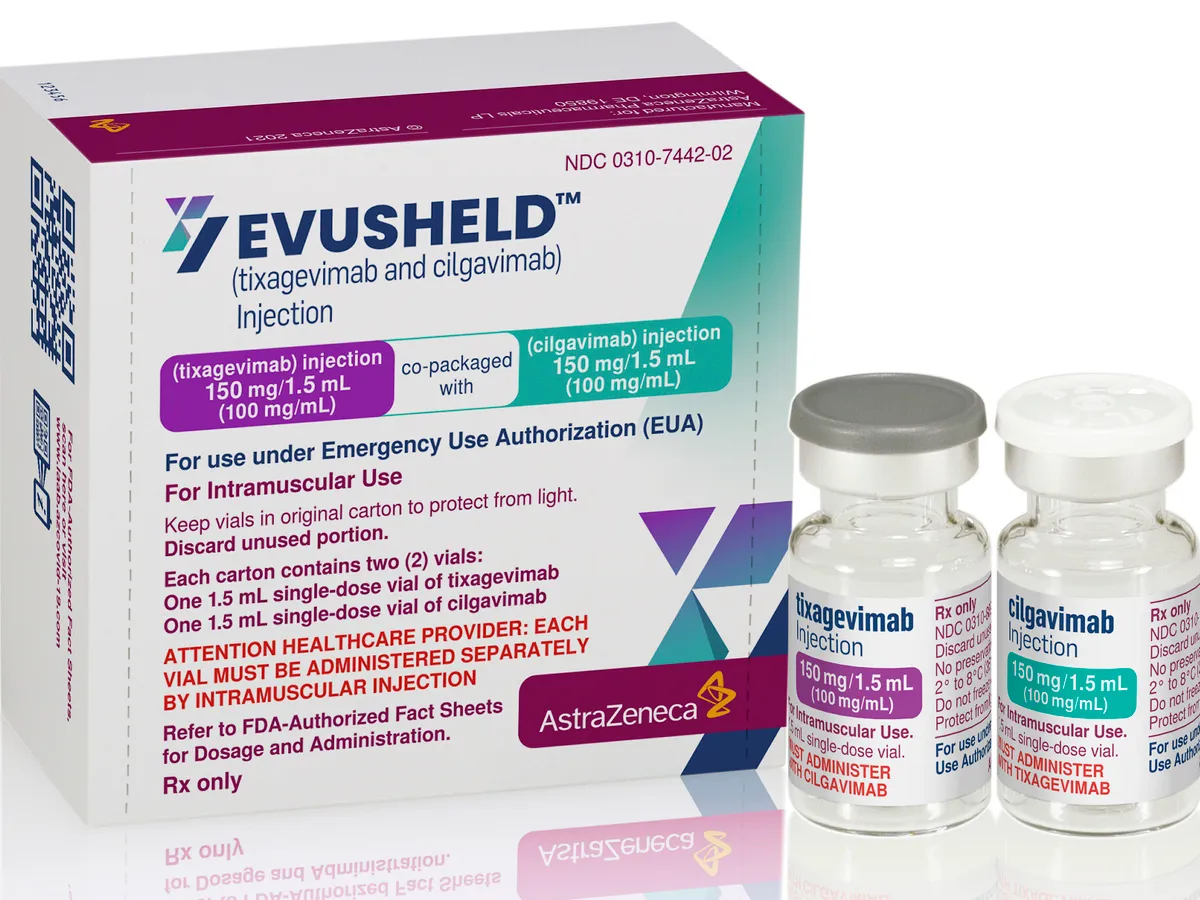
Denumit „Evusheld", tratamentul combină două tipuri de anticorpi de sinteză (tixagevimab şi cilgavimab) şi se administrează sub formă de două injecţii intramusculare administrate imediat una după alta.
Aceşti anticorpi ajută sistemul imunitar să lupte împotriva virusului atunci când îl întâlneşte, ţintind proteina sa Spike, care îi permite să intre în celule pentru a le infecta.
Tratamentul „poate fi eficient pentru o prevenire pre-expunere (la virus) timp de şase luni”, precizează FDA.
Citește și: Grațian și Ciprian Duduianu acuzați că au vrut să-l ucidă pe asasinul lui Emi Pian, eliberați
El nu poate fi administrat unei persoane infectate, a subliniat agenţia americană, deşi AstraZeneca îl testează, de asemenea, pentru a trata pacienţii aflaţi în această situaţie.
Autorizarea terapiei cu anticorpi de la AstraZeneca se bazează pe un studiu clinic realizat pe persoane nevaccinate (cu vârsta peste 59 de ani sau cu o boală cronică, sau cu risc crescut de infectare), dintre care aproape 3.500 au primit tratamentul, iar 1.700, un placebo.
Riscul de a dezvolta COVID-19 s-a redus cu 77% după administrarea tratamentului.




















